 La FDA aprobó Kymriah, de Novartis, para el tratamiento de pacientes con linfoma de células B grandes en recaída que no han respondido al tratamiento en primera línea. Se trata de la segunda indicación aprobada para este fármaco. La FDA aprobó Kymriah, de Novartis, para el tratamiento de pacientes con linfoma de células B grandes en recaída que no han respondido al tratamiento en primera línea. Se trata de la segunda indicación aprobada para este fármaco.
Según un comunicado enviado por la compañía, Kymriah, un tipo de medicamento CAR-T, ha sido el primero de su tipo en recibir aprobación adicional para uso terapéutico por parte de la FDA.
La primera indicación de este fármaco recibió la aprobación de la FDA el año pasado. Kymriah está también indicado para el tratamiento de pacientes con leucemialinfoblástica aguda recurrente, menores de 25 años y con un coste de 475.000 dólares.
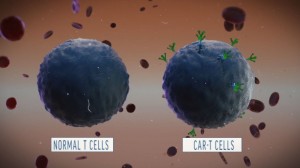
La terapia CAR-T se basa en una serie de células T receptoras e antígenos quiméricos, por lo que se trata de una inmunoterapia personalizada. El tratamiento funciona extrayendo las células sanguíneas inmunes de un paciente y modificándolas con el objetivo de combatir el cáncer. Una vez tratadas, estas células se vuelven a inyectar en el flujo sanguíneo del paciente para así atacar el cáncer.
Segundo tratamiento para esta indicación
Con esta aprobación Novartis se sitúa en competencia con Yescarta, un medicamento fabricado por Gilead Sciences Inc. Este tratamiento fue aprobado a finales del año pasado para la misma indicación terapéutica y tiene un precio de 373.000 dólares.
Las ventas de Kymriah en el primer trimestre ascendieron a 12 millones de dólares, según informó la compañía en un comunicado reciente. Con esta nueva aprobación de la FDA las ventas de este medicamento podrían crecer notablemente en el segundo trimestre de este año. |