Regdanvimab no ha sido evaluado hasta el momento por los Estados Unidos ni la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica de nuestro país. Está autorizado para su comercialización provisoria y bajo monitoreo en Europa.
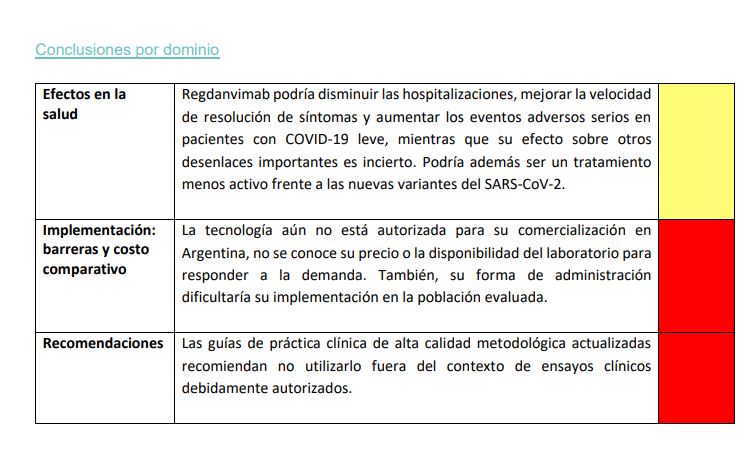
Regdanvimab podría disminuir las hospitalizaciones, mejorar la velocidad de resolución de síntomas y aumentar los eventos adversos serios en pacientes con COVID-19 leve, mientras que su efecto sobre otros desenlaces importantes es incierto. Se necesita más información para confirmar o descartar estas conclusiones. La evidencia proveniente de estudios in vitro, nos muestra que podría no ser activa frente a las nuevas variantes del SARS-CoV-2, incluida Omicrón y sus sub-variantes en estudio. La forma de administración, su precio incierto y su extensa población objetivo, podrían constituir barreras para su uso. Las guías de práctica clínica de alta calidad metodológica actualizadas recomiendan no utilizarlo por fuera del contexto de ensayos clínicos debidamente autorizados.
Para descargar el documento completo: informe-conetec-covid-19-n18-regdanvimab