ACTA Nº 44 -PAMI
ALTAS DE PRODUCTOS
La Comisión de Convenio de PAMI autorizó a partir del 23 de febrero altas y bajas de productos, mediante la recomendación de la Gerencia de Medicamentos de PAMI que realizó el análisis técnico sanitario.
BAJAS
El 24 de diciembre de 2020 se publicó en el Boletín Oficial de nuestro país la disposición 9209/2020 de ANMAT que estableció el retiro del mercado de ranitidina, por presentar contaminación con nitrosodimetilamina (NDMA), un carcinógeno humano.
En consecuencia, el 29 de diciembre de 2020, esta Comisión procedió a indicar la baja del Vademecum del INSSJP de todas las formas farmacéuticas orales que contengan ranitidina y sus combinaciones a dosis fijas a fin de resguardar la seguridad de las personas afiliadas.
Hasta su retiro, la ranitidina, era el único inhibidor del R H2 en el Vademécum del INSSJP y contaba en diciembre de 2020 con 119.127 usuarios en el Instituto. La famotidina es un inhibidor de la secreción ácida gástrica que actúa mediante la inhibición competitiva de los receptores de histamina H2, de las células parietales gástricas.
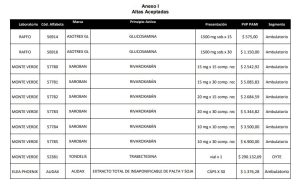
En consecuencia y atento a las solicitudes de altas de productos presentadas, tomó intervención la Secretaria General Técnico Médica y la Gerencia de Medicamentos realizó el análisis técnico sanitario y económico recomendando a la Comisión de Convenio aceptar las altas de los productos detallados en el Anexo II.
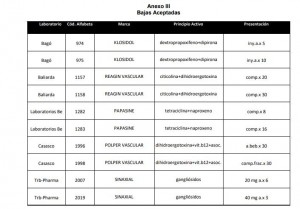
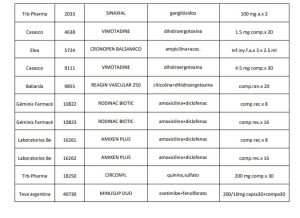
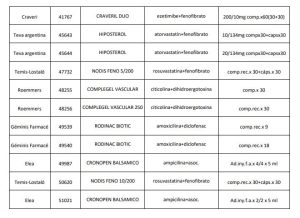
En el marco del Programa de Uso Racional de Medicamentos la Gerencia de Medicamentos emitió el informe IF-2021-10854842-INSSJP-GM#INSSJP respecto a medicamentos y asociaciones con elevado perfil de riesgo, recomendando a la Comisión de Convenio aceptar las bajas de los productos detallados en el Anexo III.
Las bajas aquí aceptadas no afectan la continuidad del tratamiento de las afiliadas y los afiliados del INSSJP, existiendo otras opciones terapéuticas en el Vademécum del INSSJP.